前沿 | 蔡宇伽/洪佳旭团队开发全新疫苗技术:树突状细胞靶向性类病毒颗粒,作为mrna疫苗载体-ag九游会官网
2024年5月7日,上海交通大学系统生物医学研究院蔡宇伽团队联合复旦大学洪佳旭、应天雷团队,上海交通大学董瑞蛟、陶生策团队,以及武汉病毒所、军事医学科学院、本导基因等多家单位在 nature biomedical engineering 期刊发表了题为:dendritic-cell-targeting virus-like particles as potent mrna vaccine carriers 的研究论文。
该研究开发了一种能够特异靶向树突状细胞(dc)、高效递送mrna和蛋白的新型疫苗平台技术——dc靶向性类病毒载体(dvlp)。
这种全新的疫苗技术既能够携带mrna也能在疫苗颗粒表面展示抗原蛋白的三维结构,具有高效激活体液免疫和细胞免疫的能力,可以显著防止新冠病毒感染,在被视为疫苗研发黑洞的单纯疱疹病毒的预防上也起到了显著的效果,为全球数亿的hsv感染者带来了治疗与预防的潜在手段。dvlp疫苗技术有望成为一个新型疫苗平台,在病毒感染、肿瘤、衰老的治疗和预防上发挥重要作用。

首先,研究团队开展了类病毒载体疫苗的概念验证研究。研究团队在目标mrna上设计了多重的ms2茎环,使其借助ms2茎环结构与ms2 coat蛋白之间的互作力, 在慢病毒gagpol蛋白自主装成类病毒载体的过程中同步装载,成为其结构的一部分。在这个过程中,身为膜蛋白的抗原将被一并装载,展示在dvlp表面。研究者通过电镜、western blot与激光共聚焦成像等多种技术手段验证了这一疫苗设计思想的成功实现。
在此基础上,研究团队开展了具有树突状细胞(dc)靶向性的类病毒载体的设计和验证工作。dc是一种最主要的抗原呈递细胞,对疫苗的效果起着十分关键的作用。目前全球唯一获批的肿瘤疫苗provenge就是一种dc疫苗。然而,provenge生产与car-t细胞治疗类似,过程复杂、繁琐,涉及患者自体细胞分离、体外制备,而后体内回输等环节。因此,有必要开发能够在体靶向dc细胞的疫苗技术,降低dc疫苗的生产成功和价格,提高患者可及性。
因此,研究团队首先对辛德比斯病毒糖蛋白sv-g工程改造,替换广谱亲和的糖蛋白vsv-g,以通过识别dc表面蛋白dc-sign实现类病毒载体对dc的特异性靶向。研究团队通过对体外dc细胞系感染和体内dc细胞的感染的追踪,验证了sv-g修饰的类病毒载体确实获得了dc细胞的靶向能力。研究团队将这种具有dc细胞靶向性的类病毒载体疫苗技术命名为dvlp。通过对mrna在体内的分布检测,研究团队发现,相比lnp,dvlp能够高效地将抗原mrna递送进dc中,且dc能够更有效地迁移至淋巴结中。与lnp mrna疫苗相比,dvlp也更有效的激活了细胞免疫。
最后,研究团队使用sars-cov-2和hsv-1两种病毒感染作为疾病模型,评估dvlp疫苗对于小鼠的保护效果。在sars-cov-2真病毒感染实验中,研究团队发现经过dvlp spike免疫的小鼠,其肺脏和气管内的病毒载量显著降低,同时肺部炎症反应减弱。在hsv-1皮肤感染模型中,研究团队发现经过dvlp gb1-gd1免疫的小鼠,产生了对hsv-1和hsv-2的交叉保护的中和抗体;免疫后小鼠皮肤和神经节中的病毒载量出现显著减少,有效阻止了hsv感染对小鼠皮肤的损伤。
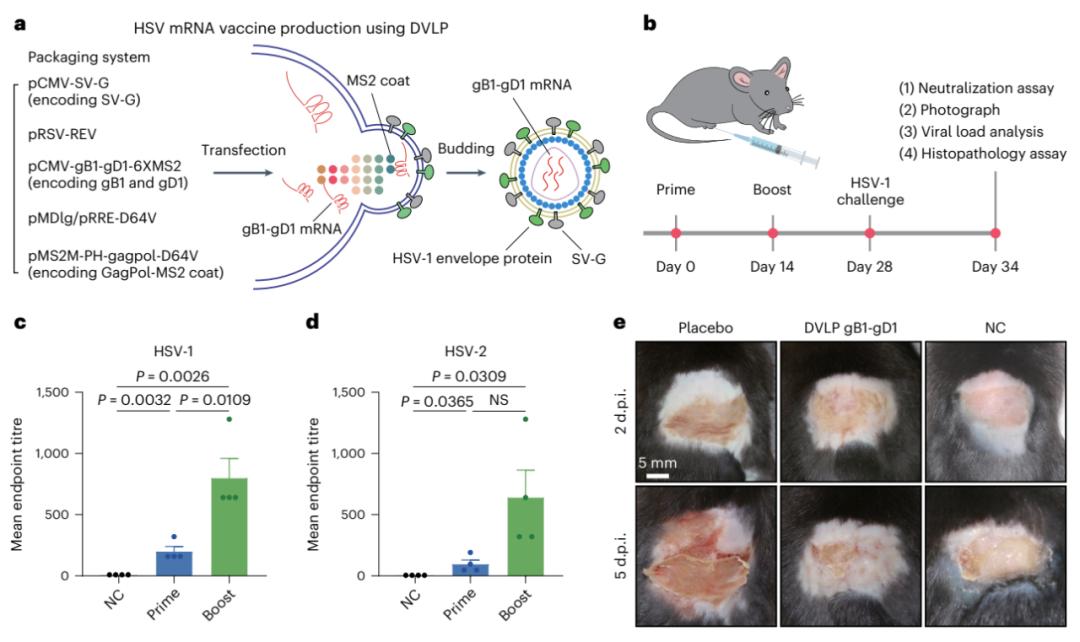
基于dvlp平台的hsv疫苗生产原理图及预防效果展示
综上所述,该研究开发了一种新型疫苗技术——dvlp,能够在体靶向dc,同时递送mrna和展示抗原蛋白,并激发强烈的体液免疫反应和细胞免疫反应。因此,dvlp有望成为一种对抗病毒感染、预防和治疗肿瘤和衰老的新一代疫苗技术。目前,基于该项疫苗技术的抗肿瘤临床研究也启动了筹备工作。
蔡宇伽为该论文最后通讯作者,洪佳旭为共同通讯作者,蔡宇伽团队的尹笛、钟亦晔、凌思凯、陆斯瑽和汪啸渊为论文共同第一作者。姜卓凡、王婕、戴瑶、田小龙、陈峻崧、许之珏、李阳等均为该研究的完成做出了重要贡献。
蔡宇伽课题组长期致力于基因治疗的转化医学研究,在靶点发现、载体开发和临床研究上均做出了重要成果。近5年来,作为通讯作者的研究成果发表在了 nature biotechnology(2021)、nature biomedical engineering(2021/2024)、cell stem cell(in press)等。团队另有数篇高水平研究成果在修回阶段。课题组对新型基因编辑和递送工具开发、肿瘤和衰老的新靶点和新疗法、人工智能与生物医学交叉有浓厚的兴趣,欢迎有相关研究背景的优秀学生和博士后加入团队,用科学和技术改变人类的生命质量和长度。(来源:)